Laporan Praktikum Kimia Dasar 1 - Termokimia Update 2017
Monday, 3 April 2017
gammafisblog.blogspot.com - kali ini saya akan coba berbagi artikel
tentang "Termokimia". Artikel kali ini mebahas salah satu
judul praktikum dari kimia dasar 1. semoga artikel yang saya berikan ini
dapat bemanfaat bagi kita teman teman yang lagi kebingungan mencari
landasan teori tentang laporannya. saya pernah mengalami hal itu, maka
dari itu saya memberikan artikel ini kepada teman teman secara gratis.
 |
| Laporan Praktikum Kimia Dasar 1 - Termokimia Update 2017 |
ACARA III
TERMOKIMIA
A. PELAKSANAAN PRAKTIKUM
1. Tujuan Praktikum
a. Untuk mempelajari perubahan energi pada reaksi kimia.
b. Untuk mengukur perubahan kalor dengan percobaan sederhana.
2. Waktu Praktikum
Jumat, 31 Oktober 2014
3. Tempat Praktikum
Laboratorium Kimia Dasar, lantai III, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Mataram.
B. LANDASAN TEORI
Termodinamika merupakan ilmu opersional, yang berhubungan dengan sifat-sifat makroskopik yang pada dasany dapat diukur. Tujuan ilmu ini adalah memprediksi jenis-jenis proses kimia dan fisika yang mungkin dan dalam kondisi yang bagaimana, serta menghitung secara kuantitatif sifat-sifat keadaan kesetimbangan yang timbul pada saat suatu proses berlangsung. Panas dan usaha, merupakan bentuk perpindahan energi kedalam(diserap) atau keluar(dilepas) dari sistem, mereka dapat dibayangkan sebagai energi dalam keadaan singgah. Jika perubahan energi disebabkan oleh kontak mekanik sistem dengan lingkungannya, maka kerja dilakukan, jika perubahan itu disebabkan oleh kontak kalor, maka kalor dipindahkan. Dalam banyak proses kalor dan usaha keduanya dapat masuk ataupun keluar dari sistem, dan perpindahan energi dalam sistem adalah jumlah dari kedua kontribusi itu. Pernyataan ini disebut hukum pertama termodinamika. Suatu sistem tidak dapat dibayangkan mengandung kerja atau kalor, sebab kerja dan kalor keduanya mengacu bukan pada keadaan sistem, tetapi pada proses yang merubah satu keadaan kekeadaan lainnya (Oxtoby, 2001 : 197).
Hukum kekekalan energi yang menyatakan bahwa energi itu kekal artinya energi awal sama denagn energi akhir. dimana energi tidak dapat diciptakan atau dimusnahkan. Enegi hanya dapat diubah dari satu bentuk kebentuk yang lain. Hukum kekekalan energi ini akan mengawasi apa yang terjadi dengan energi pada saat terjadi proses kimia dan fisik. Atom, molekul, maupun ion adalah benda-benda seperti juga beban lonceng atau magnet. Oleh karena itu, benda-benda tersebut juga mempunyai bentuk energi yang sama, yaitu energi kinetic dan energi potensial. Salah satu bentuk energi yang lazim dijumpai adalah energi kalor. Apabila sesuatu yang panas kita tempatkan disebelah benda yang dingin, kalor akan mengalir dari benda yang panas kebenda yang dingin. Kalor merupakan energi kinetic, energi kinetic dari suatu atom dan molekul. Hampir semua reaksi kimia selalu ada energi yang diambil dan dikeluarkan (Brady, 2008 : 267).
Ilmu yang mempelajari perubahan kalor yang menyertai reaksi kimia disebut termokimia. Untuk menganalisis perubahan energi pada suatu reaksi kimia pertama-tama kita harus mendefinisikan sistem, atau bagian tertentu dari alam yang menjadi perhatian kita. Sistem biasanya mencakup zat-zat yang terlibat dalam perubahan kimia dan fisika. Sisa alam yang berada diluar sistem disebut lingkungan. Setiap proses yang melepaskan kalor yaitu perpindahan energi termal kelingkungan disebut proses eksotermik. Proses endotermik dimana kalor disalurkan kesistem oleh lingkungan (Chang, 2003 : 161).
Kalor reaksi adalah kuantitas kalor yang dipertukarkan antara sistem dengan lingkungannya, jika reaksi kimia berlangsung dalam sistem pada suhu konstan. Jika suatu reaksi terjadi dalam sistem terisolasi, artinya tidak terjadi pertukaran materi atau energi dengan sekelilingnya, maka reaksi itu menghasilkan perubahan energi termal sistem. Kalor reaksi ditentukan melalui percobaan dalam suatu calorimeter, yaitu peranti untuk mengukur kuantitas kalor. Kita campurkan reaktan kedalam cangkir stirofom dan mengukur perubahan suhu. Stirofom adalah insulator kalor yang baiksehingga sangat sedikit terjadi transfer kalor antara cangkir dan udara sekeliling. Namun secara fisik calorimeter tidak dikembalikan ke kondisi awalnya. Kita hanya mengambil kalor reaksi sebagai negatif dari kuantitas kalor yang menghasilkan perubahan suhu dalam kalorimeter. Artinya, kita gunakan persamaan q_reaksi= q_kalorim (Petrucci, 2008 : 230).
Panas reaksi merupakan selisih antara kandungan panas hasil dan kandungan panas reaktan
dH = H(produk ) - H(reaktan)
Huruf latin delta (?) dipakai sebagai simbol perubahan. Para pakar kimia memakain istilah entalpi untuk kandungan panas suatu zat atau panas suatu reaksi, maka H dalam persamaaan sebelumnya berarti entalpi. Pernyataan tersebut menyatakan bahwa perubahan dalam entalpi selama reaksi sama dengan entalpi produk dikurangi entalpi reaktan. Entalpi dapat bernilai positif atau negatif. Senyawa-senyawa yang melepaskan panas ketika dibentuk dari unsure-unsurnya memiliki entalpi negatif dan zat-zat yang memerlukan panas untuk proses pembentukannya memiliki entalpi positif (Nathan, 2004:135).
Proses reaksi itu sendiri tidak tampak, artinya dianggap sebagai semacam kotak hitam. Dalam konsep kotak hitam reaksi, sebagai masukan adalah sejumlah pereaksi masing-masing dalam keadaaan murni saat dimasukkan kedalam kotak. Setelah menjalani reaksi, yang rincinya tidak dimasalahkan dalam termodinamika, kotak memberikan luaran berupa hasil-hasil reaksi yang masing-masing juga dalam keadaan murni. Perubahan entalpi, yang sering disebut pula sebagai kalor reaksi, adalah selisih antara entalpi yang masuk dan yang keluar dari kotak. Bila kalor reaksi positif reaksi disebut sebagai endoterm, sedangkan bila negatif disebut sebagai eksoterm (Imam, 2006:51).
C. ALAT DAN BAHAN PRAKTIKUM
1. Alat – Alat Praktikum
a. Buret 50 ml
b. Corong 60 mm
c. Kalorimeter
d. Termometer
e. Gelas arloji
f. Gelas ukur 100 ml
g. Gelas ukur 250 ml
h. Gelas ukur 50 ml
i. Hot plate
j. Lap
k. Pipet tetes
l. Sendok
m. Statif
n. Stopwatch
o. Timbangan analitis
p. Tissue
2. Bahan - Bahan Praktikum
a. Aquades ( H2O (l) )
b. Etanol ( C2H5OH (l) ) 96%
c. Larutan CuSO4 (aq) ( Tembaga (II) sulfat ) 1 M
d. Padatan Zn (s) ( seng )
e. Larutan HCl (aq) ( Asam klorida ) 2 M
f. Larutan NaOH (aq) ( Natrium hidroksida ) 2,05 M
D. PROSEDUR PERCOBAAN
1. Penentuan Tetapan Kalorimeter
a. Dimasukkan 40 ml aquades kedalam kalorimeter dengan gelas ukur dan dicatat suhunya.
b. Dipanaskan 40 ml aquades dalam gelas kimia 20 derajat diatas suhu kamar, catat suhunya.
c. Dicampurkan aquades yaang telah dicampurkan ke dalam kaalorimeter, dikocok dan diamati suhunya selama 10 menit dengan selang waktu 1 menit setelah pencampuraan.
2. Penentuan Kalor Reaksi Zn (s) + CuSO4 (aq)
a. Dimasukkkan 20 ml larutan CuSO4 satu M ke dalam alorimeter.
b. Dicatat suhu selama 2 menit dengan selnag waktu ½ menit.
c. ditimbanng dengan teliti 3 - 3,10 gram butirann 2n.
d. .Dimasukkan butiran 2n ke dalam kalorimeter, dicatat suhu selama 10 menit dengan selang waktu 1 menit.
3. Penentuan Kalor Pelarutan Etanol 96% Dalam Air
a. Dimasukkan 18 ml aquades ke dalam kalorimeter menggunakan gelas ukur.
b. Diukur suhu aquades dalam kalorimeter selama 2 menit dengan selanng waktu 1 menit..
c. Dimasukkan 50 ml etanol ke dalam buret dan ukur suhunya lalu diambil 29 ml etanol dari buret dengan gelas kimia, segera dicampurkan ke kalorimeter.
d. Camputran dalam kalorimeter dikocok dan dicatat suhunya selama 4 menit dengan selang wakttu ½ menit.
e. Diulangi percobaan untuk campuran aquades dan etanol denngan pernbanndingan volume berturut - turut .
4. Penentuan Kalor Penetralan HCl dan NaOH
a. Dimasukkan 20 ml HCl 2 M kedalam kalorimeter, dicatat suhunya.
b. Diukur 20 ml NaOH 2,05 M, dicatat suhunya (diatur sedemikian rupa agar suhunya sama dengan HCl).
c. NaOH segera dicampur kedalam kaorimeter, suhu campuran dicatat selama 5 menit dengan selang waktu ½ menit.
E. HASIL PENGAMATAN
Terlampuir.
F. ANALISIS DATA
Terlampir.
Untuk File Lampirannya Teman teman dapat download melalui Link dibawah ini.
Download Laporan Praktikum Kimia Dasar 1 - Termokimia.
G. PEMBAHASAN
Termokimia merupakan cabang ilmu kimia yang mempelajari lingkungan antara reaksi kimia dengan reaksi kalor atau termodinamika dapat didefinisikan ilmu yang mempelajari perubahan energi kalor pada setiap reaksi kimia. Termokimia merupakan penerapan hukum pertama termodinamika yang membahas kalor reaksi yang menyertainya. Tujuan pada praktikum ini adalah untuk mempelajari perubahan energi pada reaksi kimia dan untuk mengukur perubahan kalor dengan percobaan yang sederhana. Prinsip kerja kalorimeter adalah mengikuti azas black. Kalorimeter merupakan sistem yang terisolasi yakni sistem yang tidak mungkin terjadinya perpindahan energi dari sistem ke lingkungan. Kalorimeter yang sederhana terdiri atas logam dan dinding penyekat yang berupa plastik atau isolator, kalorimeter dapat mempertahankan kalor pelarutan. Proses mempertahankan kalor itu dilakukan kalorimeter untuk menyerap kalor tersebut. Macam kalor reaksi yakni kalor pembentukan yaitu kalor yang diperlukan untuk pembentukan 1 molsenyawa dari unsur-unsurnya. Kalor pembakaran yakni kalor yang diperlakukan untuk membakar 1 mol senyawa dari unsur-unsurnya. Kalor penetralan yakni kalor yang diperlukan untuk 1 mol H2O dari reaksi asam basa. Dan yang terakhir adalah kalor pelarutan yakni kalor yang dibutuhkan untuk melarutkan 1 mol zat padatmenjadi larutan.
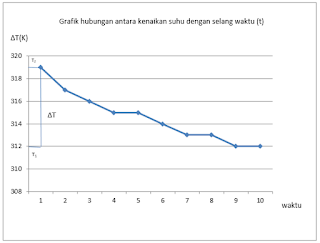
Pada percobaan pertama adalah penentuan tetapan kalorimeter. Pada percobaan ini akan ditentukan oleh nilai tetapan kalorimeter yang akan ditentuka dalam percobaan-percobaan selanjutnya untuk menentukan nilai penetapan untuk tetapan kalorimeter, harus didapatkan nilai yang diserap kalorimeter. Untuk menetapkan dan dapatkan komponen – komponen penentutetapan kalorimeter. Dilakukan pencampuran air yang berbeda suhunya yaitu air yang bersuhu 30?C dan 45?C. Sesuai dengan teori yang sudah diketahui sebelumnya suhu air panas akan dilepaskan dan diterima oleh air yang suhunya rendah. Sehingga diperoleh suhu rata-rata campuran adalah 314,6 K. Air yang suhunya rendah akan mengalami kenaikan sebesar 11,6 K dain air yang suhunya lebih tinggi, suhunya turun menjadi 3,04 K. Perbedaan penurunan dan kenaikan suhu dipengaruhi berdasarkan perhitungan yang diperoleh kalor q3 sebanyak 1.377,6 J. Pada percobaan ini digunakanair karena komposis kalor dari air lebih tinggi dibandingkan dengan yang lain dan karena air adlah pelarut yang baik.
Pada percobaan kedua yakni penentuan kalor reaks i Zn + CuSO4. Pada percobaan ini terjadi kalor pelarutanyakni pelarutan zat padat Zn untuk menjadi larutan. Kalor pelarutan merupakan penentuan perubahan energi yang terjadi pada penguraian zat padat menjadi larutan. Penentuan kalor ini didapatkan energi yang dihasilkan atau diserap oleh suatu reaksi. Pada percobaan ini terjadi perubahan suhu yang menandakan bahwa reaksi Zn + CuSO4 merupakan reaksi eksotermik, pada pencampuran ini tabung kalorimeter menjadi terasa panas dan larutan CuSO4 yang berwarna biru berubah menjadi berwarna hitam dan keruh, dikarenakan zat Zn yang terurai manjadi partikel – partikel kecil yang terdapat endapan Cu (s) karena reaksi ini termasuk reaksi redoks (penurunan dan kenaikan bolangan oksidasi).
Pada percobaan ketika yakni menentukan kalor pelarutan atanol dan air. Kalor pelarutan merupakan energi perubahan yang terjadi karena suatu zat dilarutkan dalam suatu volume pelarut. Percobaan ini dilakukan sebanyak 6 kali dimana volume antara etanol dan air berbeda-beda. Entalpi akan terus meningkat dikarenakan berkurangnya kuantitas etanol dan bertambahnya kuantitas air, suhu air larutan semakin mengecil. Perubahan suhu akhir akan menurunkan akibat volume air lebih besar dari zat yang terlarut. Besarnya kalor reaksi ditentukan oleh konsentrasi akhir larutan. Tujuan dari pengukuran suhu adalah mengetahui perubahan kalor yang terjadi pada kalorimeter. Percobaan dilakukan secara berulang kali agar hasil yang didapatkan lebih akurat pada saat membandingkan.
Percobaan keempat yakni menentukan kalor penetralan HCl dan NaOH. HCl adalah asam kuar dan NaOH adalah basa kuat. Sehingga ketika kedua senyawa tersebut bereaksi akan terjadi reaksi penetralan, reaksi ini merupakan reaksi endoterm yakni pembentukan, ini dapat dilihat dari pengukuran suhu. Penetalan ini terjadi jika kalor yang diserap suatu larutan sama dengan reaksi yang diterima. Reaksi ini menghasilkan
Perubahan entalpi sama dengan perubahan energi dalam. Perubahan energi bisa terjadi pada sistem maupun lingkungan. Sistem dapat berupa gas, uap air dan uap dalam kontak dengan cairan. Pada percobaan ke-4 yang menjadi sistem adalah HCl dan NaOH dan yang menjadi lingkungan adalah air dan sebagai medium pelarut kedua zat tersebut. Pada terksi tersebut suhu larutan meningkat dari suhu awal, hal ini terjadi karena pada saat reaksi terjadi pelepasan kalor. Kalor yang diserap oleh sistem reaksi diserap oleh lingkungan pelarut dan material lain.
H. KESIMPULAN
Berdasarkan percobaan yang dilakukan dapat disimpulkan bahwa :
a. Perubahan energi dalam kimia ada dua yaitu endoterm dan eksoterm. Reaksi endoterm terjadi jika penyerapan energi dari lingkungan ke sistem dan nilai ?H yang dihasilkan positif, sedangkan reaksi eksoterm adalah pelepasan anaergi dari sistem ke lingkungan dan nilai ?H negatif.
b. Mengukur perubahan kalor dengan percobaan sederhana menggunakan kalorimeter. Dimana kalor yang diserap oleh kalorimeter merupakan selisih kalor yang diberikan oleh larutan yang berada didalamnya.
DAFTAR PUSTAKA
Brady, James E. 2008. Kimia Universitas. Jakarta: Erlangga.
Chang, R. 2003. Kimia Dasar Prinsip-prinsip inti. Jakarta : Erlangga.
Imam, Rahayu S. 2006. Termodinamika. Bandung : Penerbit ITB.
Nathan, Harold. 2004. Cliffs QuickReview Kimia. Bandung : Pakar Raya.
Oxtoby, D.W. 2001. Prinsip-pronsip Kimia Modern. Jakarta : Erlangga.
Petrucci, R.H. 2008. Kimia Daras Prinsip-prinsip dan Aplikasi Modern. Jakarta :
Erlangga.
Laporan Praktikum Kimia Dasar 1 - Termokimia
Termokimia.
Laporan Praktikum Kimia Dasar 1.
laporan Termokimia.
landasan teori Termokimia.
Termokimia.
Termokimia.
Laporan Praktikum Kimia Dasar 1.
laporan Termokimia.
landasan teori Termokimia.
Termokimia.
Untuk File Lampirannya Teman teman dapat download melalui Link dibawah ini.
Download Laporan Praktikum Kimia Dasar 1 - Termokimia.
Itulah
artikel tentang "Pemisahan dan Pemurnian" Semoga artikel ini dapat
memberika manfaat begi teman teman pembaca, amin. saya hanya berniat
untuk berbagi kepada teman teman. Untuk itu mohon berikan komentar dan
sarannya tentang artikel ini. Terimakasih.